Mendefinisikan dan Mengarahkan Perkembangan Mikrobiota Usus pada Masa Awal Kehidupan: Tinjauan dari Segi Nutrisi
Mikrobiota Usus Manusia di Awal Kehidupan
Sejak lahir, bayi mengalami berbagai tahap perkembangan yang berdampak pada kesehatan mereka jangka panjang. Salah satu faktor penting dalam perkembangan ini adalah mikrobiota usus, yaitu kumpulan mikroorganisme di saluran pencernaan. Mikrobiota usus memiliki peran penting dalam berbagai aspek kesehatan, seperti sistem kekebalan, metabolisme, dan fungsi otak, serta dalam menyediakan energi dan melindungi dari penyakit. Oleh karena itu, mikrobiota usus menjadi target penting untuk mendukung perkembangan bayi yang sehat.
Proses pembentukan mikrobiota usus dimulai sejak lahir dan berlangsung hingga usia 3 tahun, di mana komposisi mikroorganisme di usus menjadi stabil dan mirip dengan orang dewasa. Selama periode ini, keragaman mikroorganisme di usus meningkat dan kemudian mulai menurun setelah usia 1 tahun. Komposisi mikroorganisme di usus juga menjadi lebih unik untuk setiap individu seiring waktu.
Dalam hal fungsi, mikrobiota usus berubah dari kemampuan utama untuk memecah karbohidrat sederhana dan membuat vitamin, menjadi lebih mampu memecah karbohidrat kompleks dan membuat asam lemak rantai pendek. Meskipun kecepatan perkembangan ini masih perlu diteliti lebih lanjut, jelas bahwa ini sangat terkait dengan perkembangan keseluruhan bayi dan perubahan pola makan mereka. Oleh karena itu, penelitian lebih lanjut tentang hubungan antara diet dan perkembangan mikrobiota usus sangat penting.
Mengidentifikasi Maturasi Mikrobiota yang Normal
Beberapa upaya telah dilakukan untuk menciptakan standar pengukuran selama 1.000 hari pertama kehidupan bayi. Salah satunya adalah pengembangan "tingkat kematangan mikrobiota" atau "z-scores mikrobiota-untuk-usia", yang didasarkan pada standar kurva pertumbuhan WHO. Metrik ini pertama kali diusulkan pada tahun 2014 untuk membandingkan perkembangan mikrobiota usus bayi yang menderita malnutrisi akut parah dengan bayi yang sehat. Metode ini berhasil menggambarkan penundaan dalam perkembangan ekosistem mikrobiota pada bayi yang malnutrisi dan efek intervensi nutrisi pada kelompok studi yang sama.
Kelebihan utama metode ini adalah kemampuannya untuk merangkum kompleksitas dan perkembangan ekologi mikroba selama masa bayi dalam satu variabel. Ini memungkinkan penilaian pada titik waktu tertentu apakah perkembangan ekosistem mikrobiota sesuai dengan standar usia. Selain itu, metode ini juga memungkinkan identifikasi fitur-fitur mikroba tertentu yang memberikan kontribusi besar terhadap proses perkembangan ini. Hal ini dapat memberikan petunjuk tentang mikroba spesifik yang dapat ditargetkan untuk mendukung perkembangan mikrobiota yang sesuai dengan usia (lihat Gambar 1).
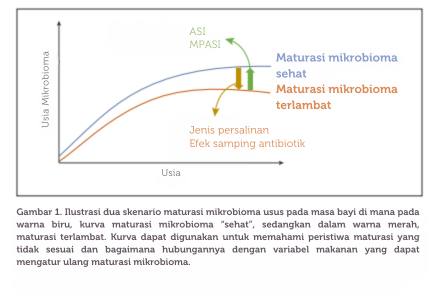
Meski pendekatan seperti ini menjanjikan dalam mengevaluasi efek intervensi atau faktor risiko terhadap perkembangan mikrobiota usus, ada beberapa keterbatasan yang perlu diperhatikan. Pertama, pendekatan ini sangat bergantung pada data dari bayi "sehat" untuk menetapkan standar perkembangan mikrobiota sebagai referensi. Biasanya, bayi yang mendapat ASI secara eksklusif dan lahir melalui persalinan normal dianggap memiliki perkembangan mikrobioma yang ideal.
Namun, faktor-faktor lain yang mungkin termasuk dalam kategori "sehat" bisa lebih subjektif, seperti penggunaan antibiotik dan efek sampingnya. Beberapa faktor penting lainnya yang mungkin menjadi bagian dari standar "sehat" bisa terlewatkan secara tidak sengaja karena variasi dalam mikrobiota usus antar individu masih belum sepenuhnya dipahami. Oleh karena itu, sangat penting untuk mengumpulkan metadata yang lengkap dan akurat bersama dengan data sekuensing, dan mengunggahnya ke repositori publik. Ini akan membantu memfasilitasi proses penyaringan yang lebih baik seiring berjalannya waktu.
Selain itu, aspek geografis dalam perkembangan mikrobiota usus juga perlu dipertimbangkan, karena ini dapat mempengaruhi generalisasi hasil penelitian. Meski membangun model dengan hanya mempertimbangkan taksonomi tingkat tinggi atau fungsi tertentu bisa menjadi pilihan, namun ini bisa mengurangi kemampuan untuk mendeteksi perubahan halus dalam mikroba pada tingkat taksonomi yang lebih rendah, yang mungkin relevan dengan fungsi tubuh manusia. Oleh karena itu, analisis yang lebih mendalam diperlukan untuk menjelaskan penyimpangan dari kondisi normal mikrobiota usus pada masa bayi.
Diet Dapat Digunakan Untuk Mendukung Maturasi Mikrobioma
Bukti pentingnya nutrisi dalam membentuk Maturasi mikrobiota pada awal kehidupan sangatlah signifikan.
Sejak lahir, terdapat perbedaan yang konsisten dalam komposisi mikrobiota antara bayi yang disusui dan yang diberi susu formula. Mikrobiota bayi yang disusui biasanya memiliki jumlah Bifidobacteriaceae yang lebih banyak, jumlah Enterobacteriaceae yang lebih sedikit, dan proses diversifikasi ekosistem yang lebih lambat hingga usia 6 bulan.
ASI juga dikaitkan dengan berbagai manfaat kesehatan, seperti penurunan risiko infeksi pada awal kehidupan dan penurunan risiko penyakit kardiometabolik, seperti diabetes tipe 1. Meskipun hubungan sebab-akibat antara mikrobiota dan manfaat kesehatan ini masih perlu diteliti lebih lanjut, hal ini menunjukkan pentingnya peran diet dalam menjaga kesehatan dan mencegah penyakit. Oleh karena itu, penting untuk mengidentifikasi komponen dalam ASI yang berkontribusi pada proses Maturasi mikrobiota, sehingga dapat dirancang alternatif yang sesuai bagi mereka yang tidak dapat mendapat ASI.
Oligosakarida susu manusia (HMO) telah diidentifikasi sebagai salah satu komponen ASI yang sangat berperan dalam memodulasi pertumbuhan mikroba tertentu, termasuk Bifidobacteriaceae, dan dalam proses Maturasi mikrobiota. Selain HMO, sphingolipid adalah senyawa lain yang ditemukan dalam ASI dan tidak ada dalam susu formula yang mungkin memiliki manfaat kesehatan pada awal kehidupan. Beberapa penelitian juga menunjukkan bahwa lipid ini, selain berperan dalam perkembangan sistem kekebalan, mungkin juga mempengaruhi komposisi mikrobiota usus. Selain itu, metabolisme senyawa-senyawa ini oleh mikroorganisme dapat mempengaruhi fungsi tubuh inang.
Ketika makanan pendamping diperkenalkan setelah periode menyusui eksklusif (sesuai dengan rekomendasi WHO), terjadi perubahan besar dalam komposisi dan diversifikasi mikrobiota usus. Studi observasional telah menggambarkan proses ini, dan mengidentifikasi hubungan antara nutrisi atau komponen tertentu dalam makanan dan komponen mikrobiota usus. Meskipun penelitian pada orang dewasa memberikan panduan tentang bagaimana diet dapat mempengaruhi mikrobiota usus, pemahaman kita tentang pengaruh diet pada mikrobiota usus masih terbatas.
Ada beberapa hal yang perlu dipertimbangkan ketika mempelajari pengaruh makanan pendamping terhadap Maturasi mikrobiota usus. Pertama, studi mikrobioma pada bayi tidak selalu mencatat asupan makanan pendamping dengan baik. Metode yang berbeda untuk mencatat pola pemberian makanan pendamping menyebabkan heterogenitas dalam data yang dikumpulkan. Oleh karena itu, informasi yang diperoleh dari studi ini menjadi terbatas dalam melakukan analisis dan perbandingan hasilnya.
Untuk mengatasi hal ini, diperlukan pengumpulan data yang lebih lengkap dan terstruktur. Pengambilan sampel tinja yang dilakukan secara longitudinal akan mencerminkan perkembangan pola makan dalam beberapa tahun pertama kehidupan. Informasi tentang waktu dan kecepatan pengenalan serta diversifikasi makanan juga perlu dicatat dengan cermat. Data ini akan membantu dalam mengevaluasi makanan yang umumnya dikonsumsi oleh bayi, dan seberapa baik makanan tersebut memengaruhi pola makan mereka.
Selain itu, pengumpulan data mengenai cara makanan diperkenalkan kepada bayi juga penting. Beberapa studi menunjukkan bahwa ada perbedaan signifikan dalam komposisi mikrobiota antara bayi yang makan makanan padat dan yang makan makanan yang dicerna terlebih dahulu. Walaupun pengumpulan data diet secara detail akan membantu dalam memahami pengaruh makanan pendamping pada Maturasi mikrobiota usus, ini juga dapat menimbulkan beban tambahan pada peserta studi.
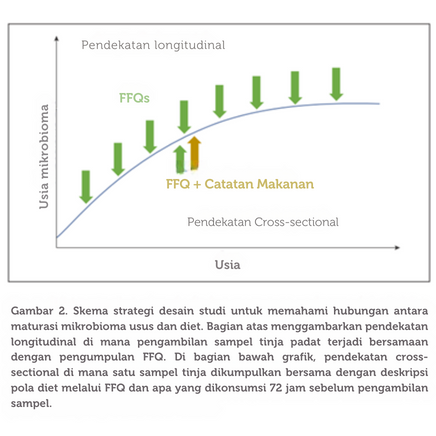
Penelitian tradisional tentang nutrisi dan pengaruhnya terhadap inang dan mikrobiota usus biasanya berfokus pada asupan nutrisi dan pola diet. Meski pendekatan ini telah membantu memahami bagaimana diet mempengaruhi kesehatan dan penyakit pada orang dewasa dan bayi, namun terbatas ketika disesuaikan dengan ekologi mikrobiota usus. Johnson dan koleganya menunjukkan bahwa melihat makanan secara keseluruhan lebih efektif dalam menjelaskan variasi mikrobiota usus antar individu. Ini karena komposisi metabolisme makanan jauh lebih kompleks daripada nutrisi yang biasanya dipelajari. Misalnya, penelitian telah menunjukkan bahwa makanan dapat mengandung lebih dari 1.000 senyawa yang berbeda. Mengingat kapasitas metabolisme mikrobiota usus dibandingkan dengan inangnya, mudah untuk melihat bagaimana komponen makanan yang sering diabaikan ini dapat berinteraksi secara kompleks dengan ekosistem mikroba usus. Selain itu, cara makanan diproses juga memiliki dampak besar pada komposisi metabolisme dan ketersediaan senyawa, yang pada gilirannya mempengaruhi mikrobiota usus. Oleh karena itu, melihat makanan dalam konteks globalnya, bukan hanya sebagai kombinasi nutrisi terbatas, dapat meningkatkan pemahaman kita tentang bagaimana diet mempengaruhi mikrobiota usus.
Namun, memandang diet dari perspektif makanan juga memiliki kelemahan utama. Sementara nutrisi dikonsumsi secara universal, sumber makanan bergantung pada geografi dan budaya, yang dapat membatasi transfer pengetahuan dan pembelajaran di seluruh populasi. Pendekatan yang lebih menjanjikan adalah memperluas karakterisasi komposisi molekuler makanan dalam basis data yang ada. Salah satu kandidat utama untuk inisiatif semacam itu adalah serat. Konsumsi serat telah terbukti memengaruhi komposisi mikrobiota usus dalam berbagai penelitian. Selain kuantitas serat yang dikonsumsi, kualitasnya juga penting, dan tampaknya berperan dalam bagaimana serat membentuk mikrobiota usus. Studi masa depan dapat mengeksplorasi efek dari jenis serat individu atau senyawa makanan lainnya pada mikrobiota usus di awal kehidupan, yang dapat memberikan wawasan untuk strategi intervensi di masa depan guna mendukung Maturasi mikrobiota usus.
Mendemonstrasikan bahwa Maturasi Mikrobiota Usus Dapat Dipengaruhi oleh Praktik Pemberian Makan yang Tepat
Selain dari analisis data longitudinal, penilaian cross-sectional tentang efek diet pada mikrobiota usus juga dapat memberikan wawasan yang berharga. Setelah proses Maturasi mikrobiota usus terdefinisi dengan baik, langkah berikutnya adalah memahami bagaimana komponen makanan tertentu dapat mendukung pertumbuhan mikroba yang relevan dalam langkah-langkah Maturasi yang berbeda dalam jendela waktu yang ditentukan. Pendekatan terbaik untuk mengevaluasi hal ini adalah dengan menentukan efek paparan akut dan kronis elemen makanan pada mikrobiota usus melalui pengumpulan data kuesioner frekuensi makanan (FFQ) untuk paparan kronis, dan catatan makanan untuk paparan akut. Secara keseluruhan, data ini dapat memberikan panduan tentang bagaimana memodifikasi ekologi mikrobiota usus secara cepat, sambil menentukan strategi pemberian makan untuk mempertahankan perubahan tersebut dalam jangka panjang.
Studi intervensi kemudian dapat dilakukan untuk menunjukkan peran kausal makanan atau nutrisi tertentu dalam Maturasi mikrobiota usus. Penelitian intervensi telah menunjukkan bahwa diet dapat membentuk kembali mikrobiota usus pada bayi. Sebagai contoh, dalam sebuah uji coba kontrol acak yang melibatkan 250 bayi antara usia 4 dan 7 bulan, Plaza-Diaz dan rekan-rekannya menemukan bahwa konsumsi gandum utuh dibandingkan dengan biji-bijian murni dapat mengubah komposisi mikrobiota usus.
Terakhir, penelitian yang menginvestigasi efek jangka panjang dari diet pada mikrobiota usus akan sangat berharga karena dapat menunjukkan bagaimana intervensi pemberian makan yang tepat pada waktu yang tepat dapat memengaruhi komposisi ekosistem usus dengan potensi konsekuensi jangka panjang pada kesehatan. Sebagai contoh, sebuah penelitian terbaru yang mengevaluasi efek jangka panjang dari probiotik menemukan bahwa efeknya masih dapat terlihat hingga 1 tahun setelah periode intervensi, tanpa adanya efek samping yang signifikan. Secara keseluruhan, bukti ini menunjukkan bahwa pemrograman jangka panjang mikrobiota usus melalui intervensi yang relatif singkat adalah hal yang mungkin dilakukan.
Kesimpulan
Definisi yang akurat dari langkah-langkah Maturasi mikrobiota usus membuka peluang untuk mengidentifikasi faktor-faktor risiko yang dapat menghambat perkembangan yang normal. Dalam situasi ideal, hal ini dapat mengarah pada pengembangan kurva Maturasi yang akan menunjukkan apakah mikrobiota usus bayi mengalami deviasi dari pola kesehatan yang normal. Pengembangan kurva semacam itu membutuhkan penelitian lanjutan untuk memastikan bahwa mereka dapat diterapkan secara universal dan cukup sensitif untuk mendeteksi perubahan yang penting secara fisiologis pada inang. Setelah kurva referensi mikrobiota terbentuk, diet tampaknya menjadi cara yang paling efektif untuk mendukung proses Maturasi tersebut. Namun, cara di mana diet dapat memengaruhi Maturasi mikrobiota usus secara spesifik masih belum sepenuhnya dipahami. Hal ini terutama karena kurangnya standar dalam pengumpulan data diet dalam penelitian mikrobiota usus. Pendekatan kita dalam mengumpulkan informasi tentang makanan saat mempelajari mikrobiota usus perlu disempurnakan agar sesuai dengan kompleksitas metabolisme ekosistem tersebut. Studi di masa depan harus fokus pada pengumpulan data diet yang komprehensif untuk memungkinkan analisis yang lebih baik tentang efek pengenalan makanan, diversifikasi, dan pembentukan pada Maturasi mikrobiota usus. Penelitian semacam ini akan membantu dalam pengembangan pedoman dan intervensi nutrisi yang dapat mendukung Maturasi mikrobiota usus yang optimal.
Referensi
- Marchesi JR, Ravel J. The vocabulary of microbiome research: a proposal. Microbiome. 2015;3:1– 3.
- Vatanen T, Franzosa EA, Schwager R, et al. The human gut microbiome in early-onset type 1 diabetes from the TEDDY study. Nature. 2018;562:589–94.
- Stewart CJ, Ajami NJ, O’Brien JL, et al. Temporal development of the gut microbiome in early childhood from the TEDDY study. Nature. 2018;562:583–8.
- Subramanian S, Huq S, Yatsunenko T, et al. Persistent gut microbiota immaturity in malnourished Bangladeshi children. Nature. 2014;510:417–21.
- Bokulich NA, Chung J, Battaglia T, et al. Antibiotics, birth mode, and diet shape microbiome maturation during early life. Sci Transl Med. 2016;8:343.
- Dogra SK, Chung CK, Wang D, et al. Nurturing the early life gut microbiome and immune maturation for long term health. Microorganisms. 2021;9:2110.
- Dogra SK, Martin FP, Donnicola D, et al. Human milk oligosaccharide-stimulated bifidobacterium species contribute to prevent later respiratory tract infections. Microorganisms. 2021;9:1939.
- Vandenplas Y, Berger B, Carnielli VP, et al. Human milk oligosaccharides: 2′-fucosyllactose (2′- FL) and lacto-N-neotetraose (LNnT) in infant formula. Nutrients. 2018;10:1161.
- Berger B, Porta N, Foata F, et al. Linking human milk oligosaccharides, infant fecal community types, and later risk to require antibiotics. mBio. 2020;11:e03196–19.
- Liu F, He S, Yan J, et al. Longitudinal changes of human milk oligosaccharides, breastmilk microbiome and infant gut microbiome are associated with maternal characteristics. Int J Food Sci Technol. 2022;57:2793–807.
- Mattner J, DeBord KL, Ismail N, et al. Exogenous and endogenous glycolipid antigens activate NKT cells during microbial infections. Nature. 2005;434:525–9.
- Kinjo Y, Wu D, Kim G, et al. Recognition of bacterial glycosphingolipids by natural killer T cells. Nature. 2005;434:520–5.
- Heaver SL, Johnson EL, Ley RE. Sphingolipids in host–microbial interactions. Curr Opin Microbiol. 2018;43:92–9.
- Rohrhofer J, Zwirzitz B, Selberherr E, et al. The impact of dietary sphingolipids on intestinal microbiota and gastrointestinal immune homeostasis. Front Immunol. 2021;12:635704.
- Laursen MF, Andersen LB, Michaelsen K, et al. Infant gut microbiota development is driven by transition to family foods independent of maternal obesity. mSphere. 2016;1:e00069–15.
- Homann CM, Rossel CA, Dizzell S, et al. Infants’ first solid foods: impact on gut microbiota development in two intercontinental cohorts. Nutrients. 2021;13:2639.
- Leong C, Haszard JJ, Lawley B, et al. Mediation analysis as a means of identifying dietary components that differentially affect the fecal microbiota of infants weaned by modified baby-led and traditional approaches. Appl Environ Microbiol. 2018;84:e00914–18.
- Shim JS, Oh K, Kim HC. Dietary assessment methods in epidemiologic studies. Epidemiol Health. 2014;36.
- Amoutzopoulos B, Steer T, Roberts C, et al. Traditional methods v. new technologies–dilemmas for dietary assessment in large-scale nutrition surveys and studies: a report following an international panel discussion at the 9th International Conference on Diet and Activity Methods (ICDAM9). J Nutr Sci. 2018;7.
- Le Roy CI, Bowyer RC, Castillo-Fernandez JE, et al. Dissecting the role of the gut microbiota and diet on visceral fat mass accumulation. Sci Rep. 2019;9:1–10.
- Bowyer RC, Jackson MA, Pallister T, et al. Use of dietary indices to control for diet in human gut microbiota studies. Microbiome. 2018;6:1–11.
- Johnson AJ, Vangay P, Al-Ghalith GA, et al. Daily sampling reveals personalized diet-microbiome associations in humans. Cell Host Microbe. 2019;25:789–802.
- Barabási AL, Menichetti G, Loscalzo J. The unmapped chemical complexity of our diet. Nature Food. 2020;1:33–7.
- Carmody RN, Bisanz JE, Bowen BP, et al. Cooking shapes the structure and function of the gut microbiome. Nat Microbiol. 2019;4:2052–63.
- So D, Whelan K, Rossi M, et al. Dietary fiber intervention on gut microbiota composition in healthy adults: a systematic review and metaanalysis. Am J Clin Nutr. 2018;107:965–83.
- Deehan EC, Yang C, Perez-Muñoz ME, et al. Precision microbiome modulation with discrete dietary fiber structures directs short-chain fatty acid production. Cell Host Microbe. 2020;27:389– 404.
- Leeming ER, Louca P, Gibson R, et al. The complexities of the diet-microbiome relationship: advances and perspectives. Genome Med. 2021;13:1–14.
- Leeming ER, Johnson AJ, Spector TD, et al. Effect of diet on the gut microbiota: rethinking intervention duration. Nutrients. 2019;11:2862.
- Plaza-Diaz J, Bernal MJ, Schutte S, et al. Effects of whole-grain and sugar content in infant cereals on gut microbiota at weaning: a randomized trial. Nutrients. 2021;13:1496.
- O’Brien CE, Meier AK, Cernioglo K, et al. Early probiotic supplementation with B. infantis in breastfed infants leads to persistent colonization at 1 year. Pediatr Res. 2022;91:627–36.
