
BAB II - Peran Gut Brain Axis dalam Kesehatan Anak
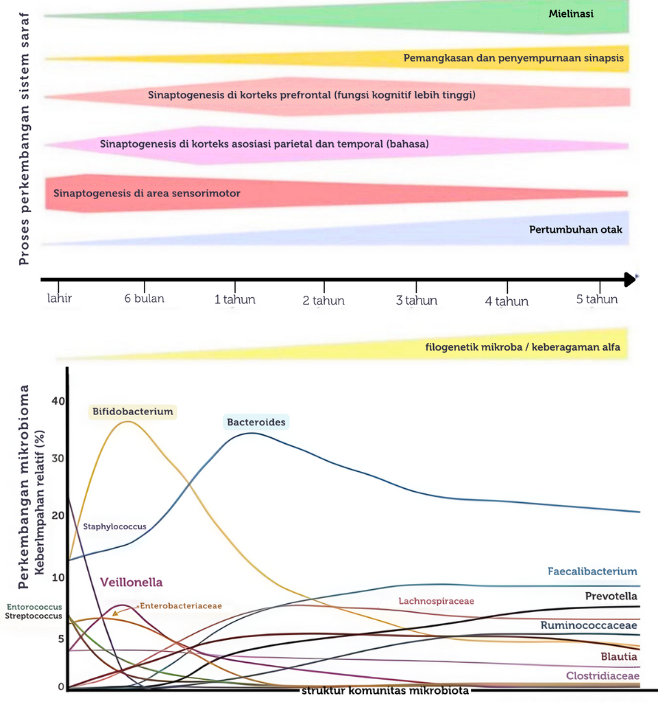
Gambar 2. Pertumbuhan neurologis (atas) dan komposisi mikrobiota (bawah) pada anak sampai umur 5 tahun (dimodifikasi dari Vaher K dkk, 2022).27
Kolonisasi mikrobiota pada seorang bayi dimulai sejak proses kelahiran dan akan terus berkembang hingga menyerupai komposisi mikrobiota usus dewasa pada usia 3 tahun. Pada masa krusial ini juga terjadi perkembangan yang pesat dari sistem saraf dan sistem imun pada anak. Akibatnya, berbagai kondisi yang dapat memengaruhi perkembangan mikrobiota usus pada usia tersebut berpotensi menyebabkan berbagai masalah kesehatan jangka panjang, terutama yang melibatkan sistem saraf dan imunitas.26
Perkembangan Gut Brain Axis dan Mikrobiota Usus pada Anak
Perkembangan sistem saraf pada masa postnatal terjadi khususnya pada sel glia (astrosit, mikroglia dan oligodendrosit), terutama dalam 1 tahun awal kehidupan. Mikroglia memiliki peran dalam mengatur neurogenesis, sementara astrosit mendukung plastisitas dan pembentukan sinaps, serta oligodendrosit berperan dalam pembentukan mielin. Ketiga sel glia ini memiliki periode perkembangan yang bervariasi.26 Proliferasi sel mikroglia berlangsung utamanya pada masa pascanatal awal, sementara astrosit dan oligodendrosit telah berproliferasi sejak di dalam kandunan (prenatal) dan berlangsung hingga setelah kelahiran. Sementara itu, proses sinaptogenesis dan mielinisasi juga telah terjadi sejak di dalam kandungan dan mencapai puncaknya ketika awal tahun kehidupan. Pada 2 tahun awal kehidupan, otak juga mengalami perkembangan struktural yang sangat pesat dan mencapai 80% dari total volume otak dewasa.26
Bersamaan dengan berkembangnya sistem saraf, saluran cerna juga mengalami berbagai perkembangan serta kolonisasi mikrobiota. Pada periode postnatal sampai usia 1 tahun, terjadi proliferasi sel kripta usus sehingga meningkatkan luas permukaan usus untuk absorpsi nutrisi. Sistem saraf enteral, terutama pada pleksus myenteric dan submukosa, juga mengalami maturasi pada awal tahun kehidupan.26
Pada awal minggu pertama kehidupan, mikrobiota usus pada bayi didominasi oleh bakteri anaerob fakultatif seperti Enterobacteriaceae, yang berasal dari vagina atau kulit ibu. Pada usia sekitar 6 bulan, komposisi mikrobiota mulai didominasi oleh kelompok bakteri anaerob obligat seperti kelompok bakteri Bifidobacterium, Clostridium dan Bacteroides. Terkahir, pada usia 3 tahun, mikrobiota usus anak akan menyerupai mikrobiota usus pada dewasa dan didominasi oleh bakteri Clostridium coccoides, Clostridium leptum dan Prevotella. Selain bakteri, mikrobiota usus juga tersusun atas mikroorganisme lain seperti bakterifag jenis Caudovirales dan Microviridae, archaea jenis Methanobrevibacter smithii dan jamur jenis Candida albicans.27, 28
Proses kolonisasi mikrobiota pada usus, maturasi saluran cerna dan sistem saraf enteral terjadi bersamaan dengan terbentuknya sinaps pada otak dan perkembangan kognitif. Berbagai bukti penelitian juga mendukung adanya asosiasi antara proses kolonisasi mikrobiota usus dengan perkembangan otak anak hingga usia 3 tahun.28 Hal ini didukung dengan adanya penelitian yang membuktikan bahwa pada anak dengan jumlah Bacteroides yang melimpah (high abundance) pada tinjanya memiliki kemampuan kognitif yang lebih bagus, terutama pada kemampuan bahasa reseptif dan ekspresif.29
Di sisi lain, anak dengan komposisi Faecalibacterium yang lebih dominan menunjukkan kemampuan kognitiif yang lebih rendah. Studi lain juga mengidentifikasi adanya hubungan positif antara diversitas alfa pada mikrobiota usus dengan konektivitas area motorik dan lobus parietal inferior pada otak.30 Pada penelitian di tikus coba steril (germ free) juga ditemukan adanya gangguan kecemasan berlebih, aktivitas motorik yang abnormal, meningkatnya respons stres dan gangguan memori. Selain itu, tikus steril (germ free) juga memproduksi neurotransmiter serotonin yang lebih sedikit pada saluran cerna. Perkembangan sistem saraf enteral juga diketahui mengalami gangguan pada tikus steril (germ free).28 Pleksus myenteric pada kelompok tikus tersebut memiliki densitas sel saraf yang lebih rendah serta berkurangnya ukuran ganglion.27
Gambar 2 menunjukkan proses perkembangan mikrobiota usus dan neurologis pada anak yang terjadi dalam waktu yang bersamaan.27 Bakteri komensal pada saluran cerna juga bertanggung jawab atas produksi gamma-aminobutyric acid (GABA), dopamin, noradrenalin, dan histamin, yang keseluruhannya penting dalam proses perkembangan saraf dan neurofisiologi pada anak.27 Komunikasi antara saluran cerna, mikrobiota usus, dan sistem saraf pusat terjadi melalui aksis hipotalamus-hipofisis-adrenal (aksis HPA), sistem saraf enterik dan otonom, serta sinyal-sinyal neurohormon.28
eseluruhan komponen tersebut dipengaruhi oleh metabolit mikroba dan juga dimediasi oleh sistem imun tubuh. Sel imun beserta sitokin yang dihasilkan memiliki peranan penting dalam perkembangan neurofisiologi, terutama pada perkembangan sel mikroglia dan astrosit. Keseluruhan interaksi antara mikrobiota, sel imun dan sel saraf ini diduga menjadi faktor utama yang memengaruhi perkembangan sistem organ satu dengan lainnya.28
Pengaruh Gut Brain Axis dalam Tumbuh dan Kembang Anak
Pada tahun pertama kehidupan pascalahir, otak mengalami perkembangan yang signifikan, termasuk peningkatan volume jaringan dan kompleksitas serta mielinisasi, dengan berbagai lobus dan jaringan yang mencapai kematangan pada usia yang berbeda-beda.31 Perubahan-perubahan ini mendukung seorang anak dalam memperoleh keterampilan bahasa, motorik dan sosial. Seiring dengan periode perkembangan otak dan kognitif yang cukup pesat, mikrobiota usus yang terbentuk dengan cepat saat lahir, juga mengalami perkembangan yang dinamis.32
Hal ini mendasari adanya hipotesis mengenai adanya periode sensitif pada perkembangan otak dimana adanya interaksi antara susunan saraf pusat dengan mikrobiota usus untuk membentuk perilaku yang lebih kompleks termasuk proses pembelajaran dan memori pada anak.33 Beberapa studi mendukung bahwa sinyal dari mikrobiota diperlukan dalam beberapa aspek tertentu dari perkembangan otak.34 Penelitian terbaru juga mendukung teori bahwa sinyal yang dihasilkan oleh beberapa jenis bakteri tertentu selama masa kritis di awal kehidupan diperlukan untuk perkembangan neurobehavioral.35 Sebaliknya, gangguan perkembangan mikrobiota selama periode ini dapat berdampak pada perkembangan fungsi kognitif secara bersamaan.33, 34
Sebuah penelitian longitudinal yang dilakukan oleh Sardillo et al. menunjukkan adanya hubungan antara keberlimpahan (abundance) jenis mikrobiota tertentu pada usia 3-6 bulan dengan kemampuan neurokognitif pada anak ketika usia 3 tahun.36 Peningkatan keberlimpahan Bacteroides dan penurunan keberlimpahan Escherichia/Shigella dan Bifidobacterium memiliki hubungan negatif dengan kemampuan motorik halus anak. Sementara itu, peningkatan keberlimpahan Lachnospiraceae dan Clostridiales serta penurunan keberlimpahan Bacteroides memiliki hubungan negatif pada kemampuan komunikasi dan personal sosial anak.36
Menariknya, penelitian lain juga membuktikan pada anak dengan kemampuan komunikasi dan personal sosial yang berkembang baik, ditemukan adanya penurunan keberlimpahan Clostridiales. Namun, dalam sisi perkembangan motorik, ditemukan bahwa kelompok bakteri Streptococcus dan Klebsiella memiliki hubungan yang paling kuat. Uniknya, kelompok Streptococcus dan Klebsiella utamanya ditemukan pada anak yang dilahirkan melalui metode sectio cesaria.37, 38
Penelitian pada bayi prematur membuktikan bahwa pada bayi yang komposisi mikrobiotanya terdiri dari Enterococcus atau Staphylococcus lebih rentan untuk mengalami gangguan neurokognitif pada usia 2 tahun dibandingkan dengan bayi yang memiliki komposisi Escherichia/Shigella, Enterobacter atau Clostridium.39 Berbagai hasil penelitian ini mendukung adanya peranan kelompok Escherichia/Shigella dan Enterobacter dalam optimalisasi perkembangan neurokognitif pada beberapa tahun awal kehidupan.
Selain itu, hasil ini juga menunjukkan bahwa komposisi mikrobiota usus selama tahun pertama kehidupan memiliki dampak yang signifikan terhadap kemampuan neurokognitif anak pada usia 2 dan 3 tahun, meskipun komposisi bakteri spesifik yang mendasari hubungan ini bervariasi antar penelitian akibat adanya perbedaan usia dan populasi yang diteliti. Selain perkembangan neurokognitif, komposisi mikrobiota usus juga memengaruhi perilaku sosial emosional serta struktur dan fungsi otak seperti yang jelaskan pada Tabel 1-3.27
Faktor - Faktor yang Dapat Memengaruhi Gut Brain Axis
Selama awal kehidupan, komposisi mikrobiota usus berubah dengan cepat berdasarkan komposisi mikrobiota ibu, metode persalinan, jenis makanan bayi, penggunaan antibiotik, dan berbagai faktor lingkungan seperti keberadaan hewan peliharaan dan ada tidaknya saudara kandung.40
Selama dalam kandungan, fetus dianggap berada di dalam lingkungan yang steril, kecuali dalam kondisi adanya infeksi seperti korioamnionitis. Namun demikian, beberapa penelitian terbaru membuktikan adanya mikrobiota non patogen pada plasenta, tali pusar serta mekonium pada bayi sehat.41
Menariknya, komposisi mikrobiota intrauterin memiliki karakteristik yang sama dengan mikrobiota pada rongga mulut ibu. Hal ini mendukung adanya transmisi mikrobiota ibu ke fetus meskipun belum diketahui dengan jelas mekanisme interaksi tersebut. Selain itu, obesitas pada ibu juga diketahui dapat memengaruhi komposisi mikrobiota pada bayi yang dilahirkan. Pada suatu studi kohort dibuktikan bahwa bayi yang dilahirkan dari ibu yang obesitas memiliki komposisi mikrobiota yang didominasi oleh filum Firmicutes dan memiliki risiko yang lebih tinggi untuk menjadi overweight pada usia 1 tahun, terutama pada anak yang lahir dengan metode sectio cesaria.42 Disbiosis yang terjadi akibat obesitas maternal juga meningkatkan permeabilitias saluran cerna serta meningkatkan risiko nonalcoholic fatty liver disease (NAFLD) di kemudian hari.43
Diet seorang ibu juga memiliki peranan yang cukup penting terhadap mikrobiota usus pada bayi. Ibu yang mengkonsumsi makanan tinggi gula dan lemak dapat meningkatkan bakteri pro inflamasi pada mikrobiota usus bayi sehingga terjadi disbiosis.44 Penggunaan antibiotik selama kehamilan pada ibu memiliki dampak negatif terhadap komposisi mikrobiota usus pada bayi dan memiliki konsekuensi jangka panjang terhadap gut brain axis serta perkembangan neurokognitif. Selain itu, ibu yang mendapat antibiotik juga memiliki komposisi mikrobiota seperti Lactobacillus dan Bifidobacteria yang lebih rendah pada air susunya.45 Kondisi alergi pada ibu, konsumpsi alkohol, merokok dan stres juga telah dibuktikan dapat memengaruhi komposisi mikrobiota pada bayi yang baru lahir.46
Menariknya, pemberian beberapa strain probiotik tertentu pada akhir masa kehamilan dapat meningkatkan jumlah spesies tertentu pada mikrobiota usus bayi yang dapat bertahan sampai usia 2 tahun.47 Namun demikian, perlu adanya kajian terhadap efek samping dan keamanan jangka panjang terhadap suplementasi tersebut.
Metode persalinan merupakan salah satu faktor utama yang menentukan kolonisasi mikrobiota pada bayi. Bayi yang dilahirkan pervaginam dikolonisasi oleh bakteri yang serupa dengan bakteri pada vagina ibu, sedangkan bayi yang di lahirkan secara sectio cesaria dikolonisasi oleh bakteri yang serupa dengan bakteri pada kulit dan rongga mulut ibu.48, 49 Penelitian jangka panjang juga membuktikan adanya keterlambatan kolonisasi bakteri filum Bacteroidetes serta rendahnya biodiversitas mikrobiota pada anak yang dilahirkan secara sectio cesaria pada usia 2 tahun.50 Namun demikian, sebuah penelitian melaporkan bahwa pada bayi yang dilahirkan secara sectio cesaria yang terjadi karena kondisi gawat darurat memiliki karakteristik mikrobiota yang menyerupai vagina ibu. Hal ini diduga akibat adanya kondisi pecah ketuban yang kerap kali terjadi pada kondisi gawat darurat sehingga memungkinkan adanya infiltrasi mikrobiota dari vagina ke bayi.51 Selain itu, bayi preterm yang umumnya menerima antibiotik serta perawatan lama di rumah sakit juga memiliki komposisi mikrobiota yang berbeda, dimana mikrobiota yang utama merupakan bakteri anaerob fakultatif seperti Enterobacteriaceae, Enterococcus dan Staphylococcus.52
Selain kondisi prenatal dan natal, kolonisasi bakteri juga dipengaruhi oleh berbagai faktor postnatal, terutama air susu ibu (ASI). ASI diketahui memiliki berbagai manfaat seperti membantu perkembangan integritas usus dan sistem imun serta mencegah berbagai penyakit seperti infeksi saluran nafas, infeksi saluran cerna, asma dan dermatitis.53 Selain itu, ASI juga merupakan media transmisi mikrobiota dari ibu ke bayi dimana ASI mengandung 1x104 sampai 1x106 bakteri.54 Bifidobacterium dan Lactobacillus yang berada di dalam ASI diketahui dapat mengaktifkan sel plasma yang menghasilkan imunoglobulin A dalam saluran cerna bayi.55 Selain itu, ASI juga mengandung human milk oligosaccharides (HMO) yang merupakan prebiotik sehingga mendukung perkembangan Bifidobacterium pada saluran cerna bayi.56
Penggunaan obat-obatan seperti antibiotik dan proton pump inhibitors (PPI) pada bayi diketahui dapat mengubah komposisi mikrobiota usus. Pemberian antibiotik terutama pada usia 1 bulan pertama berpotensi untuk mengganggu perkembangan mikrobiota usus bayi baik dalam jangka pendek maupun panjang.57 Selain itu, bayi yang mendapat antibiotik juga lebih rentan mengalami kejadian autoimun seperti asma dan alergi susu sapi serta overweight akibat adanya gangguan pada keseimbangan sel T helper.58
Penggunaan PPI dalam jangka waktu 8 minggu diketahui dapat mengubah komposisi mikrobiota usus. Pada bayi yang mendapatkan PPI diketahui memiliki Lactobacilli dan Stenotrophomonas yang lebih sedikit dan Haemophilus yang lebih banyak. Lebih jauh lagi, pada kelompok bayi tersebut juga ditemukan keberlimpahan yang menurun pada filum Firmicutes, Bacteroidetes dan Proteobacteria.59 Secara klinis, bayi yang menerima PPI dalam jangka waktu lama memiliki risiko yang lebih tinggi untuk terjadi necrotizing enterocolitis (NEC), sepsis awitan lambat dan infeksi Clostridium difficile.60 Berbagai faktor yang dapat memengaruhi komposisi mikrobiota usus bayi dapat dilihat pada Gambar 3.61
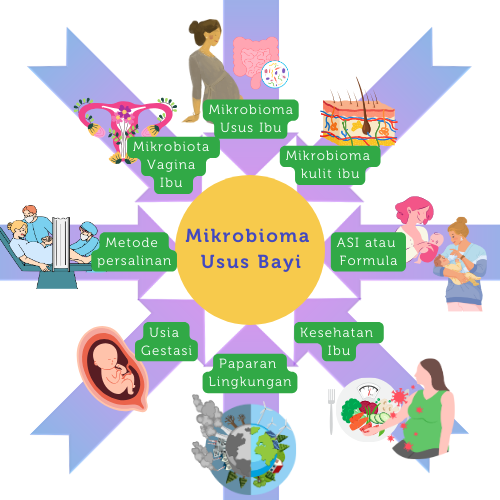
Gambar 3. Berbagai faktor yang dapat memengaruhi mikrobiota usus bayi (dimodifikasi dari Jeong S dkk, 2022).61
Gangguan Mikrobiota Usus (Disbiosis) pada Anak
Komposisi mikrobiota usus sangat memengaruhi perkembangan sistem imun dan neurokognitif pada anak. Adanya gangguan pada mikrobiota usus atau dikenal sebagai disbiosis tidak hanya memengaruhi saluran cerna pada anak, tetapi juga dapat mengganggu perkembangan sistem imun dan sistem saraf pusat.
Beberapa penelitian mengungkapkan adanya hubungan antara disbiosis mikrobiota usus dengan kejadian gangguan gastrointestinal fungsional seperti kolik infantil, konstipasi fungsional dan irritable bowel syndrome (IBS). Bayi dengan kolik infantil terjadi disbiosis yang ditandai dengan meningkatnya keberlimpahan Proteobacteria dan berkurangnya keberlimpahan Lactobacillus dan Bifidobacterium serta berkurangnya diversitas mikrobiota usus.62
Disamping itu, pemberian probiotik yang mengandung Lactobacillus reuteri DSM17938 telah diteliti dapat mengurangi gejala kolik infantil pada bayi yang diberikan ASI.63 Hal ini semakin mendukung adanya peranan mikrobiota usus dalam patogenesis kolik infantil. Selain kolik infantil, sakit perut fungsional seperti irritable bowel syndrome (IBS) dan dispepsia fungsional juga telah diteliti memiliki hubungan dengan adanya disbiosis mikrobiota usus. Suatu penelitian melaporkan pada anak dengan irritable bowel syndrome (IBS) memiliki peningkatan keberlimpahan Prevotella, Lactobacillus, Veillonella dan Parasporo, namun berkurangnya keberlimpahan Verrucomicrobium serta Bifidobacterium.64 Pada kasus konstipasi fungsional juga ditemukan adanya disbiosis dimana terjadi peningkatan bakteri penghasil butirat seperti Roseburia, Coprococcus dan Faecalibacterium yang dikaitkan dengan intake probiotik yang rendah.65
Selain gangguan gastrointestinal fungsional, disbiosis mikrobiota usus juga ditemukan pada bayi dengan necrotizing enterocolitis (NEC). NEC merupakan suatu kegawatdaruratan saluran cerna dengan mortalitas yang tinggi. Penyakit ini umumnya terjadi pada bayi preterm dan memiliki hubungan kuat dengan adanya perubahan komposisi mikrobiota usus akibat pemberian antibiotik dan perawatan di rumah sakit. Disbiosis serta berkurangnya diversitas mikrobiota usus telah diteliti berdampak terhadap kejadian komplikasi NEC yang lebih tinggi serta terjadinya sepsis awitan lambat.66 Sebuah penelitian juga melaporkan berkurangnya keberlimpahan Lactobacillus dan meningkatnya dominasi Citrobacter koseri serta Klebsiella pneumoniae dikaitkan dengan risiko terjadinya NEC yang lebih tinggi pada bayi preterm.67
Selain NEC, disbiosis mikrobiota usus juga ditemukan pada anak dengan inflammatory bowel disease (IBD). Pada kondisi IBD, ditemukan berkurangnya keberlimpahan bakteri komensal seperti Bacteroides, Bifidobacteria dan Clostridium IXa dan IV serta meningkatnya bakteri patogen seperti Escherichia coli.68 Adanya disbiosis ditambah dengan gangguan fagositosis serta gangguan pada sel T regulator merupakan dasar patogenesis terjadinya IBD.69
Kondisi disbiosis tidak hanya berdampak pada saluran pencernaan, namun juga berdampak terhadap sistem imun sehingga meningkatkan risiko alergi pada anak. Pada kondisi alergi, bakteri penghasil asam butirat (salah satu asam lemak rantai pendek) pada saluran cerna jumlahnya menurun.70 Penurunan asam butirat pada usus menyebabkan berkurangnya sel T naive yang berkembang menjadi sel T regulator. Akibat berkurangnya jumlah sel T regulator, berkurang pula sitokin imunosupresan seperti IL-10 dan TGF-b sehingga menyebabkan respons imun yang berlebihan.71 Teori ini juga didukung dengan ditemukan adanya penurunan jenis bakteri Bacteroidetes dan Bifidobacterium pada anak dengan alergi makanan maupun asma.72
Kondisi disbiosis juga ditemukan pada anak dengan obesitas. Terdapat beberapa perubahan khusus mikrobiota usus pada kondisi obesitas, salah satunya adalah perubahan rasio Firmicutes dan Bacteroidetes.73 Beberapa penelitian membuktikan adanya peningkatan rasio antara Firmicutes dan Bacteroidetes yang diakibatkan oleh meningkatnya jumlah bakteri Firmicutes ataupun berkurangnya bakteri Bacteroidetes. Selain itu, pada anak obesitas juga ditemukan adanya jumlah bakteri penghasil butirat yang berkurang.73
Hal ini menjadi penting karena pada penelitian membuktikan bahwa asam lemak rantai pendek (butirat, asetat dan propionat) meningkatkan proses termogenesis pada jaringan lemak.74 Disbiosis juga berdampak terhadap integritas mukosa usus sehingga memicu terjadinya inflamasi sistemik kronis yang umumnya ditemukan pada kondisi obesitas.74 Hal ini didukung dengan adanya peningkatan lipopolisakarida bakteri pada serum pasien dengan obesitas.74 Mikrobiota usus juga dapat memodulasi nafsu makan melalui perantara nervus vagus dan berbagai neuroendokrin serta sistem imun.74
Kondisi disbiosis juga ditemukan pada anak dengan gangguan perkembangan neurokognitif seperti pada kasus gangguan spektrum autisme, attention deficit hyperactivity disorder dan gangguan epilepsi.75 Pada anak dengan gangguan spektrum autisme, tidak jarang juga ditemukan adanya komorbiditas gangguan saluran cerna akibat meningkatnya permeabilitas usus. Hal ini mendukung adanya peranan disbiosis mikrobiota pada kelompok anak dengan autisme. Selain itu, sebuah penelitian membuktikan adanya disbiosis pada anak dengan autisme dapat menyebabkan meningkatnya respons imun pro-inflamasi sehingga dihasilkan berbagai sitokin pro-inflamasi seperti IL-8 dan TNF-alfa.76
Respon imun abnormal tersebut juga dapat ditemukan pada otak anak yang menderita autisme dimana ditemukan adanya perubahan densitas dan morfologi pada sel mikroglia.77 Pada anak dengan gangguan spektrum autisme ditemukan adanya peningkatan jumlah bakteri Clostridium dan Firmicutes disertai dengan penurunanan keberlimpahan bakteri Bacteroidetes.
Tabel 1 Pengaruh berbagai jenis mikrobiota terhadap perkembangan neurokognitif (diterjemahkan dari Vaher K, dkk. 2022). 27
|
Tabel 2 Pengaruh berbagai jenis mikrobiota terhadap perilaku sosial emosional (diterjemahkan dari Vaher K, dkk. 2022).27
| ||||||||||||||||||
Tabel 3 Pengaruh berbagai jenis mikrobiota terhadap struktur dan fungsi otak (diterjemahkan dari Vaher K, dkk. 2022).27
| ||||||||||||||||||
Referensi
Appleton J. The Gut-Brain Axis: Influence of Microbiota on Mood and Mental Health. Integr Med (Encinitas). 2018;17(4):28-32
Lyte M. Microbial endocrinology in the microbiome-gut-brain axis: how bacterial production and utilization of neurochemicals influence behavior. PLoS Pathog. 2013;9(11):e1003726.https://doi.org/10.1371/journal.ppat.1003726
Mayer EA. Gut feelings: the emerging biology of gut–brain communication. Nature Reviews Neuroscience. 2011;12(8):453-66.https://doi.org/10.1038/nrn3071
Dalile B, Van Oudenhove L, Vervliet B, Verbeke K. The role of short-chain fatty acids in microbiota-gut-brain communication. Nat Rev Gastroenterol Hepatol. 2019;16(8):461-78.https://doi.org/10.1038/s41575-019-0157-3
Aresti Sanz J, El Aidy S. Microbiota and gut neuropeptides: a dual action of antimicrobial activity and neuroimmune response. Psychopharmacology (Berl). 2019;236(5):1597-609.https://doi.org/10.1007/s00213-019-05224-0
Strandwitz P, Kim KH, Terekhova D, Liu JK, Sharma A, Levering J, et al. GABA-modulating bacteria of the human gut microbiota. Nature Microbiology. 2019;4(3):396-403.https://doi.org/10.1038/s41564-018-0307-3
Morais LH, Schreiber HL, Mazmanian SK. The gut microbiota–brain axis in behaviour and brain disorders. Nature Reviews Microbiology. 2021;19(4):241-55.https://doi.org/10.1038/s41579-020-00460-0
Sgritta M, Dooling SW, Buffington SA, Momin EN, Francis MB, Britton RA, et al. Mechanisms Underlying Microbial-Mediated Changes in Social Behavior in Mouse Models of Autism Spectrum Disorder. Neuron. 2019;101(2):246-59.e6.https://doi.org/10.1016/j.neuron.2018.11.018
Abdel-Haq R, Schlachetzki JCM, Glass CK, Mazmanian SK. Microbiome-microglia connections via the gut-brain axis. J Exp Med. 2019;216(1):41-59.https://doi.org/10.1084/jem.20180794
Erny D, Hrabě de Angelis AL, Jaitin D, Wieghofer P, Staszewski O, David E, et al. Host microbiota constantly control maturation and function of microglia in the CNS. Nat Neurosci. 2015;18(7):965-77.https://doi.org/10.1038/nn.4030
Yuan N, Chen Y, Xia Y, Dai J, Liu C. Inflammation-related biomarkers in major psychiatric disorders: a cross-disorder assessment of reproducibility and specificity in 43 meta-analyses. Transl Psychiatry. 2019;9(1):233.https://doi.org/10.1038/s41398-019-0570-y
Braniste V, Al-Asmakh M, Kowal C, Anuar F, Abbaspour A, Tóth M, et al. The gut microbiota influences blood-brain barrier permeability in mice. Sci Transl Med. 2014;6(263):263ra158.https://doi.org/10.1126/scitranslmed.3009759
Stecher B. The roles of inflammation, nutrient availability and the commensal microbiota in enteric pathogen infection. Metabolism and bacterial pathogenesis. 2015:297-320
Laterza L, Rizzatti G, Gaetani E, Chiusolo P, Gasbarrini A. The gut microbiota and immune system relationship in human graft-versus-host disease. Mediterranean journal of hematology and infectious diseases. 2016;8(1)
Lozupone CA, Stombaugh JI, Gordon JI, Jansson JK, Knight R. Diversity, stability and resilience of the human gut microbiota. Nature. 2012;489(7415):220-30
Russell AB, Hood RD, Bui NK, LeRoux M, Vollmer W, Mougous JD. Type VI secretion delivers bacteriolytic effectors to target cells. Nature. 2011;475(7356):343-7.https://doi.org/10.1038/nature10244
Schamberger GP, Diez-Gonzalez F. Selection of recently isolated colicinogenic Escherichia coli strains inhibitory to Escherichia coli O157: H7. Journal of food protection. 2002;65(9):1381-7
Fukuda S, Toh H, Hase K, Oshima K, Nakanishi Y, Yoshimura K, et al. Bifidobacteria can protect from enteropathogenic infection through production of acetate. Nature. 2011;469(7331):543-7
Gantois I, Ducatelle R, Pasmans F, Haesebrouck F, Hautefort I, Thompson A, et al. Butyrate specifically down-regulates Salmonella pathogenicity island 1 gene expression. Applied and environmental microbiology. 2006;72(1):946-9
Khan I, Bai Y, Zha L, Ullah N, Ullah H, Shah SRH, et al. Mechanism of the Gut Microbiota Colonization Resistance and Enteric Pathogen Infection. Front Cell Infect Microbiol. 2021;11:716299.https://doi.org/10.3389/fcimb.2021.716299
Rowland I, Gibson G, Heinken A, Scott K, Swann J, Thiele I, et al. Gut microbiota functions: metabolism of nutrients and other food components. Eur J Nutr. 2018;57(1):1-24.https://doi.org/10.1007/s00394-017-1445-8
Dai Z-L, Li X-L, Xi P-B, Zhang J, Wu G, Zhu W-Y. L-Glutamine regulates amino acid utilization by intestinal bacteria. Amino acids. 2013;45:501-12
Hill M. Intestinal flora and endogenous vitamin synthesis. European Journal of Cancer Prevention. 1997;6(2):S43-S5
Reigstad CS, Salmonson CE, Rainey III JF, Szurszewski JH, Linden DR, Sonnenburg JL, et al. Gut microbes promote colonic serotonin production through an effect of short-chain fatty acids on enterochromaffin cells. The FASEB Journal. 2015;29(4):1395
Cryan JF, Dinan TG. Mind-altering microorganisms: the impact of the gut microbiota on brain and behaviour. Nature Reviews Neuroscience. 2012;13(10):701-12.https://doi.org/10.1038/nrn3346
Laue HE, Coker MO, Madan JC. The Developing Microbiome From Birth to 3 Years: The Gut-Brain Axis and Neurodevelopmental Outcomes. Frontiers in Pediatrics. 2022;10.https://doi.org/10.3389/fped.2022.815885
Vaher K, Bogaert D, Richardson H, Boardman JP. Microbiome-Gut-Brain Axis in brain development, cognition and behavior during infancy and early childhood. Developmental Review. 2022;66:101038.https://doi.org/https://doi.org/10.1016/j.dr.2022.101038
Laue HE, Coker MO, Madan JC. The Developing Microbiome From Birth to 3 Years: The Gut-Brain Axis and Neurodevelopmental Outcomes. Front Pediatr. 2022;10:815885.https://doi.org/10.3389/fped.2022.815885
Cryan JF, O’Riordan KJ, Cowan CSM, Sandhu KV, Bastiaanssen TFS, Boehme M, et al. The Microbiota-Gut-Brain Axis. Physiological Reviews. 2019 Oct 1;99(4):1877–2013.
Gao W, Salzwedel AP, Carlson AL, Xia K, Azcarate-Peril MA, Styner MA, et al. Gut microbiome and brain functional connectivity in infants-a preliminary study focusing on the amygdala. Psychopharmacology. 2019 Jan 2;236(5):1641–51.
Gilmore JH, Knickmeyer RC, Gao W. Imaging structural and functional brain development in early childhood. Nature Reviews Neuroscience. 2018;19(3):123-37
Roswall J, Olsson LM, Kovatcheva-Datchary P, Nilsson S, Tremaroli V, Simon M-C, et al. Developmental trajectory of the healthy human gut microbiota during the first 5 years of life. Cell host & microbe. 2021;29(5):765-76. e3
Callaghan B. Nested sensitive periods: how plasticity across the microbiota-Gut-Brain Axis interacts to affect the development of learning and memory. Current opinion in behavioral sciences. 2020;36:55-62
Cowan CS, Dinan TG, Cryan JF. Annual Research Review: Critical windows–the microbiota–gut–brain axis in neurocognitive development. Journal of Child Psychology and Psychiatry. 2020;61(3):353-71
Buffington SA, Di Prisco GV, Auchtung TA, Ajami NJ, Petrosino JF, Costa-Mattioli M. Microbial reconstitution reverses maternal diet-induced social and synaptic deficits in offspring. Cell. 2016;165(7):1762-75
Sordillo JE, Korrick S, Laranjo N, Carey V, Weinstock GM, Gold DR, et al. Association of the infant gut microbiome with early childhood neurodevelopmental outcomes: an ancillary study to the VDAART randomized clinical trial. JAMA network open. 2019;2(3):e190905-e
Shao Y, Forster SC, Tsaliki E, Vervier K, Strang A, Simpson N, et al. Stunted microbiota and opportunistic pathogen colonization in caesarean-section birth. Nature. 2019;574(7776):117-21
Reyman M, van Houten MA, van Baarle D, Bosch AA, Man WH, Chu MLJ, et al. Impact of delivery mode-associated gut microbiota dynamics on health in the first year of life. Nature communications. 2019;10(1):4997
Rozé J-C, Ancel P-Y, Marchand-Martin L, Rousseau C, Montassier E, Monot C, et al. Assessment of neonatal intensive care unit practices and preterm newborn gut microbiota and 2-year neurodevelopmental outcomes. JAMA network open. 2020;3(9):e2018119-e
Rinninella E, Raoul P, Cintoni M, Franceschi F, Miggiano G, Gasbarrini A, et al. What is the Healthy Gut Microbiota Composition? A Changing Ecosystem across Age, Environment, Diet, and Diseases. Microorganisms. 2019 Jan 10;7(1):14.
Jiménez E, Marín ML, Martín R, Odriozola JM, Olivares M, Xaus J, et al. Is meconium from healthy newborns actually sterile? Res Microbiol. 2008;159(3):187-93.https://doi.org/10.1016/j.resmic.2007.12.007
Tun HM, Bridgman SL, Chari R, Field CJ, Guttman DS, Becker AB, et al. Roles of Birth Mode and Infant Gut Microbiota in Intergenerational Transmission of Overweight and Obesity From Mother to Offspring. JAMA Pediatr. 2018;172(4):368-77.https://doi.org/10.1001/jamapediatrics.2017.5535
Soderborg TK, Clark SE, Mulligan CE, Janssen RC, Babcock L, Ir D, et al. The gut microbiota in infants of obese mothers increases inflammation and susceptibility to NAFLD. Nat Commun. 2018;9(1):4462.https://doi.org/10.1038/s41467-018-06929-0
Spreadbury I. Comparison with ancestral diets suggests dense acellular carbohydrates promote an inflammatory microbiota, and may be the primary dietary cause of leptin resistance and obesity. Diabetes Metab Syndr Obes. 2012;5:175-89.https://doi.org/10.2147/dmso.S33473
Jiménez E, de Andrés J, Manrique M, Pareja-Tobes P, Tobes R, Martínez-Blanch JF, et al. Metagenomic Analysis of Milk of Healthy and Mastitis-Suffering Women. J Hum Lact. 2015;31(3):406-15.https://doi.org/10.1177/0890334415585078
Jeong S. Factors influencing development of the infant microbiota: From prenatal period to early infancy. Clinical and Experimental Pediatrics. 2022;65(9):438
Lahtinen SJ, Boyle RJ, Kivivuori S, Oppedisano F, Smith KR, Robins-Browne R, et al. Prenatal probiotic administration can influence Bifidobacterium microbiota development in infants at high risk of allergy. J Allergy Clin Immunol. 2009;123(2):499-501.https://doi.org/10.1016/j.jaci.2008.11.034
Dominguez-Bello MG, Costello EK, Contreras M, Magris M, Hidalgo G, Fierer N, et al. Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns. Proc Natl Acad Sci U S A. 2010;107(26):11971-5.https://doi.org/10.1073/pnas.1002601107
MacIntyre DA, Chandiramani M, Lee YS, Kindinger L, Smith A, Angelopoulos N, et al. The vaginal microbiome during pregnancy and the postpartum period in a European population. Sci Rep. 2015;5:8988.https://doi.org/10.1038/srep08988
Bokulich NA, Chung J, Battaglia T, Henderson N, Jay M, Li H, et al. Antibiotics, birth mode, and diet shape microbiome maturation during early life. Sci Transl Med. 2016;8(343):343ra82.https://doi.org/10.1126/scitranslmed.aad7121
Kim G, Bae J, Kim MJ, Kwon H, Park G, Kim SJ, et al. Delayed Establishment of Gut Microbiota in Infants Delivered by Cesarean Section. Front Microbiol. 2020;11:2099.https://doi.org/10.3389/fmicb.2020.02099
Tirone C, Pezza L, Paladini A, Tana M, Aurilia C, Lio A, et al. Gut and Lung Microbiota in Preterm Infants: Immunological Modulation and Implication in Neonatal Outcomes. Front Immunol. 2019;10:2910.https://doi.org/10.3389/fimmu.2019.02910
Fernández L, Langa S, Martín V, Maldonado A, Jiménez E, Martín R, et al. The human milk microbiota: origin and potential roles in health and disease. Pharmacol Res. 2013;69(1):1-10.https://doi.org/10.1016/j.phrs.2012.09.001
Heikkilä MP, Saris PE. Inhibition of Staphylococcus aureus by the commensal bacteria of human milk. J Appl Microbiol. 2003;95(3):471-8.https://doi.org/10.1046/j.1365-2672.2003.02002.x
Stsepetova J, Sepp E, Julge K, Vaughan E, Mikelsaar M, de Vos WM. Molecularly assessed shifts of Bifidobacterium ssp. and less diverse microbial communities are characteristic of 5-year-old allergic children. FEMS Immunol Med Microbiol. 2007;51(2):260-9.https://doi.org/10.1111/j.1574-695X.2007.00306.x
Vandenplas Y, Berger B, Carnielli VP, Ksiazyk J, Lagström H, Sanchez Luna M, et al. Human Milk Oligosaccharides: 2'-Fucosyllactose (2'-FL) and Lacto-N-Neotetraose (LNnT) in Infant Formula. Nutrients. 2018;10(9).https://doi.org/10.3390/nu10091161
Zeissig S, Blumberg RS. Life at the beginning: perturbation of the microbiota by antibiotics in early life and its role in health and disease. Nat Immunol. 2014;15(4):307-10.https://doi.org/10.1038/ni.2847
Francino MP. Antibiotics and the Human Gut Microbiome: Dysbioses and Accumulation of Resistances. Front Microbiol. 2015;6:1543.https://doi.org/10.3389/fmicb.2015.01543
Castellani C, Singer G, Kashofer K, Huber-Zeyringer A, Flucher C, Kaiser M, et al. The Influence of Proton Pump Inhibitors on the Fecal Microbiome of Infants with Gastroesophageal Reflux-A Prospective Longitudinal Interventional Study. Front Cell Infect Microbiol. 2017;7:444.https://doi.org/10.3389/fcimb.2017.00444
Levy EI, Hoang DM, Vandenplas Y. The effects of proton pump inhibitors on the microbiome in young children. Acta Paediatr. 2020;109(8):1531-8.https://doi.org/10.1111/apa.15213
Jeong S. Factors influencing development of the infant microbiota: from prenatal period to early infancy. Clin Exp Pediatr. 2022;65(9):439-47.https://doi.org/10.3345/cep.2021.00955
Dubois NE, Gregory KE. Characterizing the Intestinal Microbiome in Infantile Colic: Findings Based on an Integrative Review of the Literature. Biol Res Nurs. 2016;18(3):307-15.https://doi.org/10.1177/1099800415620840
Sung V, D'Amico F, Cabana MD, Chau K, Koren G, Savino F, et al. Lactobacillus reuteri to Treat Infant Colic: A Meta-analysis. Pediatrics. 2018;141(1).https://doi.org/10.1542/peds.2017-1811
Rigsbee L, Agans R, Shankar V, Kenche H, Khamis HJ, Michail S, et al. Quantitative profiling of gut microbiota of children with diarrhea-predominant irritable bowel syndrome. Am J Gastroenterol. 2012;107(11):1740-51.https://doi.org/10.1038/ajg.2012.287
Dimidi E, Christodoulides S, Fragkos KC, Scott SM, Whelan K. The effect of probiotics on functional constipation in adults: a systematic review and meta-analysis of randomized controlled trials. Am J Clin Nutr. 2014;100(4):1075-84.https://doi.org/10.3945/ajcn.114.089151
Patole S. Microbiota and Necrotizing Enterocolitis. Psychopharmacology (Berl). 2017 Mar 27;236(5):81–94.
Dobbler PT, Procianoy RS, Mai V, Silveira RC, Corso AL, Rojas BS, et al. Low Microbial Diversity and Abnormal Microbial Succession Is Associated with Necrotizing Enterocolitis in Preterm Infants. Front Microbiol. 2017;8:2243.https://doi.org/10.3389/fmicb.2017.02243
Fava F, Danese S. Intestinal microbiota in inflammatory bowel disease: friend of foe? World J Gastroenterol. 2011;17(5):557-66.https://doi.org/10.3748/wjg.v17.i5.557
Niess JH. Role of mucosal dendritic cells in inflammatory bowel disease. World J Gastroenterol. 2008;14(33):5138-48.https://doi.org/10.3748/wjg.14.5138
Di Costanzo M, De Paulis N, Biasucci G. Butyrate: A Link between Early Life Nutrition and Gut Microbiome in the Development of Food Allergy. Life. 2021 Apr 23;11(5):384.
Sansom DM, Walker LS. The role of CD28 and cytotoxic T-lymphocyte antigen-4 (CTLA-4) in regulatory T-cell biology. Immunol Rev. 2006;212:131-48.https://doi.org/10.1111/j.0105-2896.2006.00419.x
Akagawa S, Kaneko K. Gut microbiota and allergic diseases in children. Allergology International. 2022;71(3):301-9.https://doi.org/https://doi.org/10.1016/j.alit.2022.02.004
Cho KY. Association of gut microbiota with obesity in children and adolescents. Clin Exp Pediatr. 2023;66(4):148-54. https://doi.org/10.3345/cep.2021.01837
van Son J, Koekkoek LL, La Fleur SE, Serlie MJ, Nieuwdorp M. The Role of the Gut Microbiota in the Gut–Brain Axis in Obesity: Mechanisms and Future Implications. International Journal of Molecular Sciences. 2021 Mar 15;22(6):2993.
Coomey R, Stowell R, Majewska A, Tropea D. The Role of Microglia in Neurodevelopmental Disorders and their Therapeutics. Curr Top Med Chem. 2020;20(4):272-6.https://doi.org/10.2174/1568026620666200221172619
Zhao H, Zhang H, Liu S, Luo W, Jiang Y, Gao J. Association of Peripheral Blood Levels of Cytokines With Autism Spectrum Disorder: A Meta-Analysis. Front Psychiatry. 2021;12:670200.https://doi.org/10.3389/fpsyt.2021.670200
Lee AS, Azmitia EC, Whitaker-Azmitia PM. Developmental microglial priming in postmortem autism spectrum disorder temporal cortex. Brain Behav Immun. 2017;62:193-202.https://doi.org/10.1016/j.bbi.2017.01.019
