BAB I - Pengenalan Gut Brain Axis
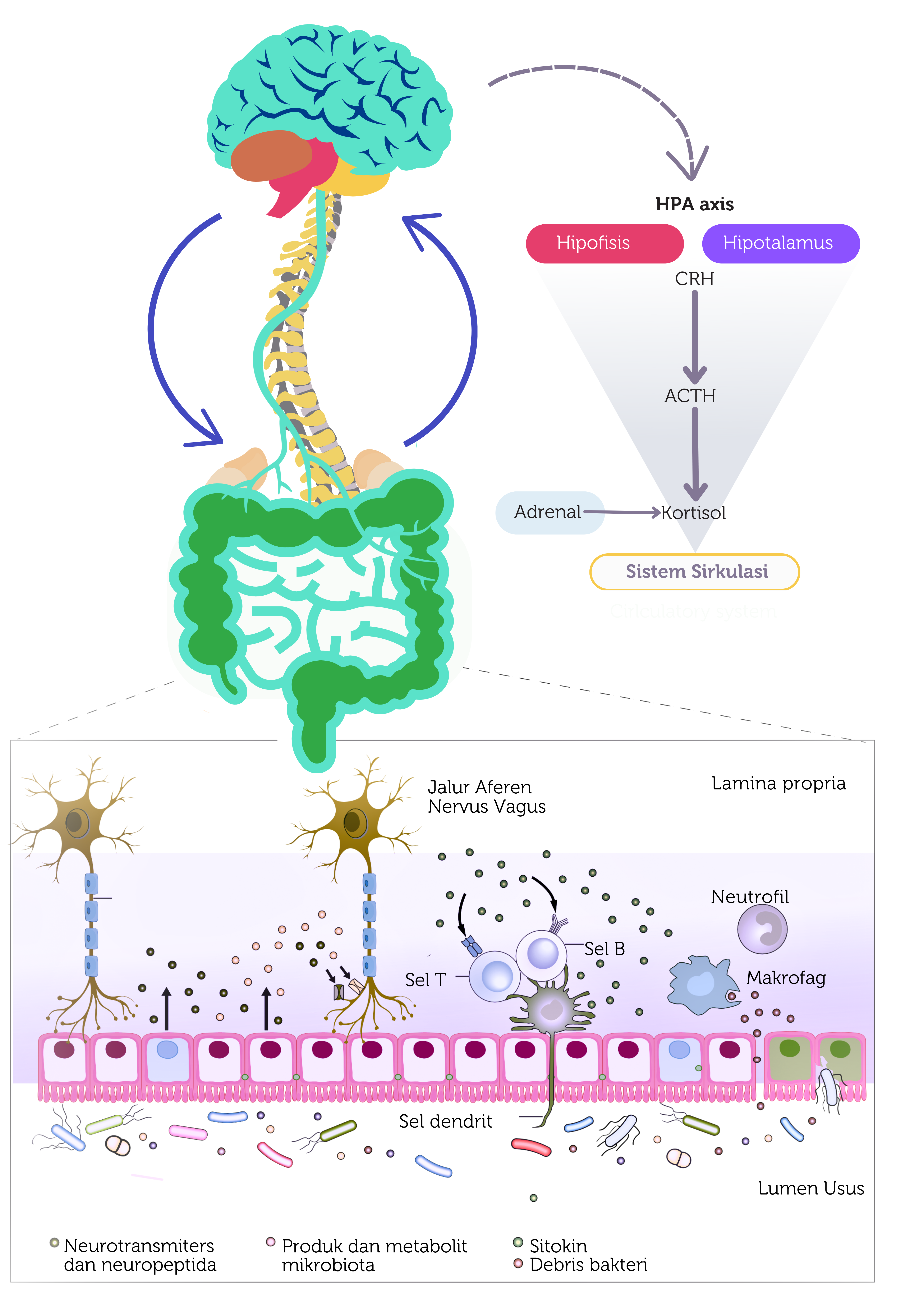
Gambar 1. Mekanisme dan peranan berbagai sistem organ pada gut-brain axis (dimodifikasi dari Morais et al LH 2021).
Gut Brain Axis merupakan suatu jaringan komunikasi dua arah yang menjembatani hubungan antara usus (terutama sistem saraf enteral) dengan sistem saraf pusat dan sebaliknya.1 Jaringan ini tersusun secara kompleks yang tidak hanya melibatkan struktur anatomis, tetapi juga melibatkan berbagai sistem organ seperti sistem endokrin, metabolik serta imun. Sebagai contoh, sistem saraf otonom, aksis hiptalamus-pituitari-adrenal (aksis HPA), serta serabut saraf pada saluran cerna seluruhnya diketahui memiliki peran dalam komunikasi antara saluran cerna dan otak.1
Selain itu, penelitian terbaru juga mengungkapkan pengaruh mikrobiota usus terhadap sistem saraf pusat dengan memproduksi berbagai metabolit, serta modulasi sistem imun pada saluran cerna dan juga mediator neurokimia. Lebih jauh lagi, mikrobiota usus juga telah dibuktikan memiliki peranan dalam proses terjadinya berbagai penyakit neuropsikiatri seperti gangguan spektrum autisme, depresi, gangguan kecemasan dan juga penyakit neurodegeneratif.2, 3
Komunikasi Gut Brain Axis Melalui Mediator Kimiawi
Terdapat berbagai jalur yang memungkinkan mikrobiota usus dalam memengaruhi fungsi sistem saraf pusat, salah satunya adalah melalui senyawa kimiawi. Asam lemak rantai pendek (short chain fatty acid/SCFA) merupakan suatu produk metabolit yang dihasilkan oleh mikrobiota usus dari hasil fermentasi serat makanan.4 Senyawa ini diketahui dapat memodulasi sistem saraf pusat melalui pengaturan neuroplastisitas, epigenetik dan ekspresi gen.4 Percobaan pada tikus menunjukkan bahwa pemberian asam lemak rantai pendek secara eksogen dapat memicu ekspresi brain derived neurotrophic factor (BDNF), suatu faktor neuronal yang diasosiasikan dengan depresi.5
Terlebih lagi, pada hari ke-28 terlihat tikus percobaan menunjukkan tingkah laku yang menyerupai gejala depresi. Selain melalui metabolit yang dihasilkan, mikrobiota usus juga dapat memengaruhi produksi hormon glucagon-like peptide 1 (GLP-1) pada sel enteroendokrin sehingga dapat mengatur nafsu makan serta pola makan seseorang.5 Beberapa spesies mikrobiota usus diketahui dapat berinteraksi dengan susunan sistem saraf melalui produksi neurotransmiter seperti golongan bakteri Bacteroides, Bifidobacterium, Parabacteroides dan Escherichia spp yang dapat memproduksi neurotransmiter gamma-aminobutyric acid (GABA).6 Serotonin (5-hydroxytryptamine (5-HT)), suatu neurotransmiter yang diproduksi oleh sel enteroendokrin, juga dipengaruhi produksinya oleh metabolit dari mikrobiota seperti asam lemak rantai pendek. Mikrobiota usus juga dapat memengaruhi integritas mukosa usus sehingga dapat memodulasi senyawa kimia yang berada di dalam lumen usus untuk dapat bertranslokasi ke lamina propria dan sirkulasi porta.7
Komunikasi Gut Brain Axis Melalui Perantara Persarafan
Jalur persarafan utama antara sistem saraf pusat dengan saluran cerna diperantai utamanya oleh nervus vagus, yang menghubungkan antara batang otak dan sistem saraf enterik. Nervus ini mempersarafi lapisan mukosa dan otot saluran cerna dan juga berfungsi untuk mendeteksi sinyal kimiawi pada saluran cerna yang kemudian diteruskan ke susunan saraf pusat. Transmisi sinyal tersebut diperantai oleh adanya mekanoreseptor yang dapat merasakan adanya perubahan volume intralumen, serta adanya kemoreseptor yang dapat mendeteksi adanya senyawa kimiawi seperti neurotransmiter ataupun metabolit mikrobiota. Sebagai contoh, asam lemak rantai pendek yang dihasilkan oleh mikrobiota usus dapat mengaktifkan kanal kalsium pada kemoreseptor saluran cerna dan kemudian diteruskan oleh nervus vagus ke otak. Sebaliknya, otak juga akan mengirimkan sinyal melalui saluran cerna yang nantinya dapat memengaruhi motilitas dan fungsi saluran cerna.
Komunikasi antara mikrobiota dan usus juga dapat memengaruhi perilaku seseorang dan mood seseorang. Sebuah studi pada hewan coba membuktikan bahwa pemberian probiotik Lactobacillus rhamnosus JB-1 dapat mengubah ekspresi neurotransmiter GABA pada bagian amigdala dan hipokampus yang diasosiasikan dengan rasa takut serta kecemasan. Namun, efek tersebut tidak terlihat pada tikus yang dilakukan vagotomi. Selain itu, nervus vagus juga diketahui memiliki peranan penting dalam memediasi efek dari Lactobacillus reuteri terhadap perilaku sosial pada model tikus dengan autistic spectrum disorder (ASD).8
Komunikasi Gut Brain Axis Melalui Perantara Sistem Imun
Baik sistem saraf pusat maupun mikrobiota usus keduanya sangat dipengaruhi oleh sistem imun seseorang. Mikrobiota usus juga diketahui memiliki peran dalam maturasi sistem imun bawaan/alamiah pada otak, salah satunya adalah pada maturasi mikroglia.9 Hal ini dibuktikan pada pada beberapa studi dimana tikus yang tidak memiliki mikrobiota (germ free) usus memiliki jumlah mikroglia imatur yang lebih banyak dibandingkan dengan tikus normal. Lebih jauh lagi, penelitian tersebut juga membuktikan bahwa pemberian asam lemak rantai pendek yang merupakan hasil dari metabolit mikrobiota dapat memperbaiki fungsi dan morfologi dari mikroglia tersebut.9, 10 Keseluruhan bukti dari berbagai penelitian tersebut mendukung adanya hubungan yang kompleks antara mikrobiota usus terhadap perkembangan mikroglia di otak.
Mikrobiota usus dan sistem saraf pusat juga dapat berinteraksi melalui perantara sitokin-sitokin yang bersirkulasi secara sistemik di dalam tubuh. Pada berbagai kondisi neuropsikatri seperti depresi, gangguan kecemasan dan ASD, ditemukan adanya perubahan sitokin pada otak serta adanya peningkatan inflamasi pada tubuh.11 Perubahan sitokin ataupun kemokin pada otak pada kondisi ini dapat disebabkan oleh dua hal, yakni adanya sitokin proinflamasi yang dihasilkan oleh sel imun yang berdiam pada jaringan otak atau adanya perpindahan sitokin proinflamasi dari sirkulasi sistemik ke jaringan otak dengan menembus sawar darah otak.11 Penelitian terbaru juga membuktikan adanya peningkatan permeabilitas sawar darah otak pada tikus yang kehilangan mikrobiota usus akibat adanya penurunan ekspresi occludin dan claudin-5.12
Peran Aksis Hipotalamus-Pituitari-Adrenal
Aksis hipotalamus-pituitari-adrenal diketahui juga memiliki peranan penting dalam komunikasi antara saluran cerna dengan sistem saraf pusat, terutama otak. Kondisi stres yang berlebihan dapat mengaktifkan sel neuroendokrin pada hipotalamus untuk dapat menghasilkan hormon corticotropin receptor hormone (CRH).
Selanjutnya hormon CRH akan merangsang pituitari untuk menghasilkan hormon adenocorticotropic (ACTH) yang nantinya akan memicu kelenjar adrenal untuk menghasilkan hormon kortisol. Hormon ini nantinya dapat memengaruhi berbagai senyawa kimiawi di dalam sirkulasi sistemik yang dapat mengatur integritas mukosa usus sehingga memungkinkan metabolit mikrobiota untuk dapat masuk dan berinteraksi dengan sistem imun tubuh.7 Mekanisme dan peranan berbagai sistem organ pada gut-brain axis dapat dilihat pada Gambar 1.7
Peranan Gut-Brain Axis dalam Kesehatan secara Umum
Kolonisasi mikrobiota usus dimulai sejak proses kelahiran dimana bayi akan terpajan berbagai mikroorganisme yang berada di vagina maupun kulit ibu. Komposisi mikrobiota ini akan terus berkembang sampai anak berusia 3 tahun.13 Secara umum, mikrobiota usus tersusun oleh 6 filum utama, yaitu Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria, Fusobacteria, dan Verrucomicrobia, dengan kelompok Firmicutes dan Bacteroidetes merupakan kelompok terbanyak.14 Selain itu, kelompok jamur yang paling sering berada di saluran cerna adalah Candida, Saccharomyces, Malassezia, dan Cladosporium. Selain bakteri dan jamur, mikrobiota usus manusia juga tersusun oleh berbagai macam virus dan archaea.15 Pada kondisi yang optimal, mikrobiota usus dapat berperan dalam memproteksi terhadap patogen, mencerna dan absorpsi nutrisi, serta mendukung perkembangan berbagai sistem organ, seperti sistem saraf dan sistem imun.
Salah satu peranan penting dari mikrobiota usus adalah memberikan resistensi terhadap kolonisasi bakteri patogen. Untuk mencegah adanya kompetisi dengan berbagai bakteri patogen, mikrobiota usus memiliki berbagai mekanisme pertahanan. Salah satu mekanisme pertahanan yang dimaksud yaitu dengan memproduksi bacteriocins yang dapat membunuh bakteri intra- maupun interspesies.16 Sebagai contoh, bakteri E. coli komensal dapat menghasilkan bacteriocins yang berguna untuk menghambat bakteri Entero-Hemorrhagic E. coli (EHEC).17 Selain itu, mikrobiota usus juga memiliki kemampuan untuk memodulasi pH di dalam saluran cerna sehingga dapat menghambat kolonisasi bakteri enteropatogen. Mekanisme ini diperantai oleh adanya asam lemak rantai pendek yang dapat menurunkan pH lumen usus. Beberapa strain probiotik yang mengandung bakteri Bifidobacterium telah dibuktikan dapat mencegah pertumbuhan bakteri E. coli patogen dengan mekanisme tersebut.18 Mekanisme lain dari mikrobiota usus dalam mencegah kolonisasi bakteri patogen adalah dengan berkompetisi langsung dengan bakteri patogen dengan memperebutkan komponen nutrisi yang sama sehingga menghambat pertumbuhan bakteri patogen tersebut. Selain itu, metabolit mikrobiota juga dapat mengurangi virulensi berbagai bakteri salah satunya adalah bakteri Salmonella.19 Lebih jauh lagi, mikrobiota usus juga memiliki kemampuan dalam meningkatkan imunitas terutama pada saluran cerna dengan memperbaiki integritas saluran cerna serta meningkatkan kerja sistem imun bawaan/alamiah.20
Berbagai spesies mikrobiota usus telah diketahui memiliki peranan penting dalam pemecahan berbagai nutrisi. Sebagai contoh, spesies Bacteroides yang berada di usus besar berperan dalam pemecahan polisakarida yang kemudian diubah menjadi propionat yang merupakan salah satu asam lemak rantai pendek.21 Beberapa penelitian juga menunjukkan adanya peranan mikrobiota usus dalam pemecahan protein sehingga meningkatkan absorpsi asam amino.22 Sintesis vitamin K dan beberapa tipe vitamin B juga sangat bergantung terhadap keberadaan mikrobiota.23 Selain itu, mikrobiota usus juga memengaruhi motilitas saluran cerna melalui modulasi serotonin yang dihasilkan oleh sel enterokromafin.24
Selain bermanfaat untuk saluran cerna, mikrobiota usus juga berperan penting dalam modulasi perilaku dan mood. Hal ini dibuktikan pada percobaan dimana tikus yang tidak memiliki mikrobiota usus menunjukkan perilaku ansietas dan stres yang berlebih dibandingkan dengan tikus normal.25 Disamping itu, pada otak tikus steril (germ free) tersebut juga ditemukan adanya perubahan komposisi brain derived neurotrophic factor (BDNF), serotonin dan reseptor glutamate, faktor-faktor yang diasosiasikan dengan gangguan kecemasan.25 Menariknya, kondisi ini dapat bersifat reversibel ketika kelompok tikus steril (germ free) tersebut diterapi dengan mikrobiota yang berasal dari tikus normal.25 Dari sisi kemampuan kognitif, tikus steril (germ free) terbukti memiliki kemampuan non-spasial dan memori yang kurang baik.25
Referensi:
Appleton J. The Gut-Brain Axis: Influence of Microbiota on Mood and Mental Health. Integr Med (Encinitas). 2018;17(4):28-32
Lyte M. Microbial endocrinology in the microbiome-gut-brain axis: how bacterial production and utilization of neurochemicals influence behavior. PLoS Pathog. 2013;9(11):e1003726.https://doi.org/10.1371/journal.ppat.1003726
Mayer EA. Gut feelings: the emerging biology of gut–brain communication. Nature Reviews Neuroscience. 2011;12(8):453-66.https://doi.org/10.1038/nrn3071
Dalile B, Van Oudenhove L, Vervliet B, Verbeke K. The role of short-chain fatty acids in microbiota-gut-brain communication. Nat Rev Gastroenterol Hepatol. 2019;16(8):461-78.https://doi.org/10.1038/s41575-019-0157-3
Aresti Sanz J, El Aidy S. Microbiota and gut neuropeptides: a dual action of antimicrobial activity and neuroimmune response. Psychopharmacology (Berl). 2019;236(5):1597-609.https://doi.org/10.1007/s00213-019-05224-0
Strandwitz P, Kim KH, Terekhova D, Liu JK, Sharma A, Levering J, et al. GABA-modulating bacteria of the human gut microbiota. Nature Microbiology. 2019;4(3):396-403.https://doi.org/10.1038/s41564-018-0307-3
Morais LH, Schreiber HL, Mazmanian SK. The gut microbiota–brain axis in behaviour and brain disorders. Nature Reviews Microbiology. 2021;19(4):241-55.https://doi.org/10.1038/s41579-020-00460-0
Sgritta M, Dooling SW, Buffington SA, Momin EN, Francis MB, Britton RA, et al. Mechanisms Underlying Microbial-Mediated Changes in Social Behavior in Mouse Models of Autism Spectrum Disorder. Neuron. 2019;101(2):246-59.e6.https://doi.org/10.1016/j.neuron.2018.11.018
Abdel-Haq R, Schlachetzki JCM, Glass CK, Mazmanian SK. Microbiome-microglia connections via the gut-brain axis. J Exp Med. 2019;216(1):41-59.https://doi.org/10.1084/jem.20180794
Erny D, Hrabě de Angelis AL, Jaitin D, Wieghofer P, Staszewski O, David E, et al. Host microbiota constantly control maturation and function of microglia in the CNS. Nat Neurosci. 2015;18(7):965-77.https://doi.org/10.1038/nn.4030
Yuan N, Chen Y, Xia Y, Dai J, Liu C. Inflammation-related biomarkers in major psychiatric disorders: a cross-disorder assessment of reproducibility and specificity in 43 meta-analyses. Transl Psychiatry. 2019;9(1):233.https://doi.org/10.1038/s41398-019-0570-y
Braniste V, Al-Asmakh M, Kowal C, Anuar F, Abbaspour A, Tóth M, et al. The gut microbiota influences blood-brain barrier permeability in mice. Sci Transl Med. 2014;6(263):263ra158.https://doi.org/10.1126/scitranslmed.3009759
Stecher B. The roles of inflammation, nutrient availability and the commensal microbiota in enteric pathogen infection. Metabolism and bacterial pathogenesis. 2015:297-320
Laterza L, Rizzatti G, Gaetani E, Chiusolo P, Gasbarrini A. The gut microbiota and immune system relationship in human graft-versus-host disease. Mediterranean journal of hematology and infectious diseases. 2016;8(1)
Lozupone CA, Stombaugh JI, Gordon JI, Jansson JK, Knight R. Diversity, stability and resilience of the human gut microbiota. Nature. 2012;489(7415):220-30
Russell AB, Hood RD, Bui NK, LeRoux M, Vollmer W, Mougous JD. Type VI secretion delivers bacteriolytic effectors to target cells. Nature. 2011;475(7356):343-7.https://doi.org/10.1038/nature10244
Schamberger GP, Diez-Gonzalez F. Selection of recently isolated colicinogenic Escherichia coli strains inhibitory to Escherichia coli O157: H7. Journal of food protection. 2002;65(9):1381-7
Fukuda S, Toh H, Hase K, Oshima K, Nakanishi Y, Yoshimura K, et al. Bifidobacteria can protect from enteropathogenic infection through production of acetate. Nature. 2011;469(7331):543-7
Gantois I, Ducatelle R, Pasmans F, Haesebrouck F, Hautefort I, Thompson A, et al. Butyrate specifically down-regulates Salmonella pathogenicity island 1 gene expression. Applied and environmental microbiology. 2006;72(1):946-9
Khan I, Bai Y, Zha L, Ullah N, Ullah H, Shah SRH, et al. Mechanism of the Gut Microbiota Colonization Resistance and Enteric Pathogen Infection. Front Cell Infect Microbiol. 2021;11:716299.https://doi.org/10.3389/fcimb.2021.716299
Rowland I, Gibson G, Heinken A, Scott K, Swann J, Thiele I, et al. Gut microbiota functions: metabolism of nutrients and other food components. Eur J Nutr. 2018;57(1):1-24.https://doi.org/10.1007/s00394-017-1445-8
Dai Z-L, Li X-L, Xi P-B, Zhang J, Wu G, Zhu W-Y. L-Glutamine regulates amino acid utilization by intestinal bacteria. Amino acids. 2013;45:501-12
Hill M. Intestinal flora and endogenous vitamin synthesis. European Journal of Cancer Prevention. 1997;6(2):S43-S5
Reigstad CS, Salmonson CE, Rainey III JF, Szurszewski JH, Linden DR, Sonnenburg JL, et al. Gut microbes promote colonic serotonin production through an effect of short-chain fatty acids on enterochromaffin cells. The FASEB Journal. 2015;29(4):1395
Cryan JF, Dinan TG. Mind-altering microorganisms: the impact of the gut microbiota on brain and behaviour. Nature Reviews Neuroscience. 2012;13(10):701-12.https://doi.org/10.1038/nrn3346
If you liked this post you may also like